5月13日��,CDE官網(wǎng)顯示���,恒瑞遞交了1類新藥「注射用甲苯磺酸瑞馬唑侖」新適應癥的上市申請,并獲CDE承辦��。從目前已開展的臨床試驗來看���,本次報上市的新適應癥可能為局部**輔助鎮(zhèn)靜�����。
5月13日���,CDE官網(wǎng)顯示�,恒瑞遞交了1類新藥「注射用甲苯磺酸瑞馬唑侖」新適應癥的上市申請����,并獲CDE承辦。從目前已開展的臨床試驗來看���,本次報上市的新適應癥可能為局部**輔助鎮(zhèn)靜��。

(資料來源:CDE官網(wǎng))
2個適應癥獲批上市
甲苯磺酸瑞馬唑侖屬于苯二氮卓類��,是一種短效的GABAa受體激動劑�,由恒瑞在瑞馬唑侖結構上進行改造而來�����。瑞馬唑侖是PaionAG開發(fā)的短效GABAa受體激動劑,是在咪 達唑侖的結構基礎之上進行修飾改良的產(chǎn)品���,結合了咪 達唑侖的安全性與異丙酚的有效性�����,是理想的短效鎮(zhèn)靜/**產(chǎn)品��。但專利報道瑞馬唑侖游離堿不穩(wěn)定�����,作為瑞馬唑侖的甲苯磺酸鹽��,甲苯磺酸瑞馬唑侖相比更加穩(wěn)定。
咪 達 唑 侖�����、瑞馬唑侖和甲苯磺酸瑞馬唑侖結構圖
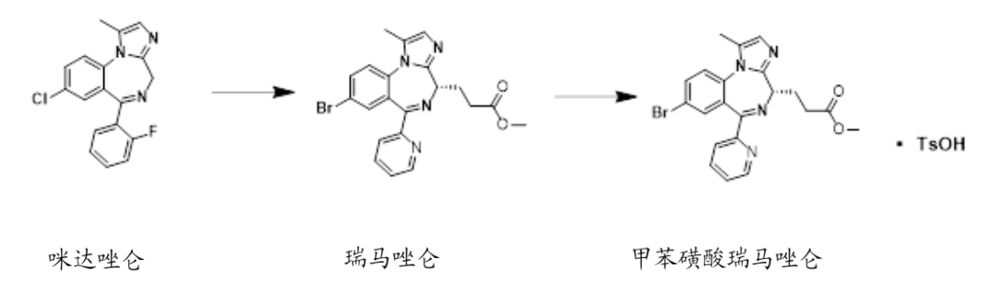
(資料來源:CNKI)
2018年3月,甲苯磺酸瑞馬唑侖首次申報上市�,并同月被納入優(yōu)先審評;2019年6月��,第2個適應癥申報上市,8月被納入優(yōu)先審評���;2020年12月�,第3個適應癥申報上市����;2021年2月,第4個適應癥申報上市��;2020年5月��,第5個適應癥申報上市����。
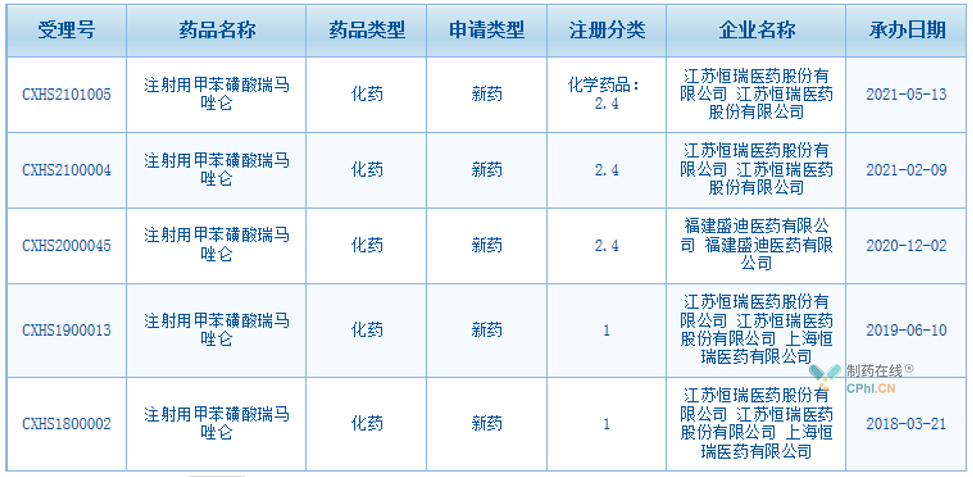
(資料來源:CDE官網(wǎng))
2019年12月,注射用甲苯磺酸瑞馬唑侖首次獲得NMPA批準用于胃鏡檢查鎮(zhèn)靜����,商品名瑞倍寧;2020年6月���,第2項適應癥上市申請獲得批準�,用于結腸鏡診療鎮(zhèn)靜�。
3個適應癥報產(chǎn)中
據(jù)藥物臨床試驗登記與信息公示平臺顯示��,目前恒瑞共針對甲苯磺酸瑞馬唑侖啟動了10項臨床試驗���,其中4項Ⅲ期臨床均已完成,1項Ⅱ期臨床試驗進行中�����。因此����,筆者推測,第3個����、第4個適應癥分別為全身**以及支氣管鏡診療鎮(zhèn)靜,第5個適應癥為局部**輔助鎮(zhèn)靜�����。
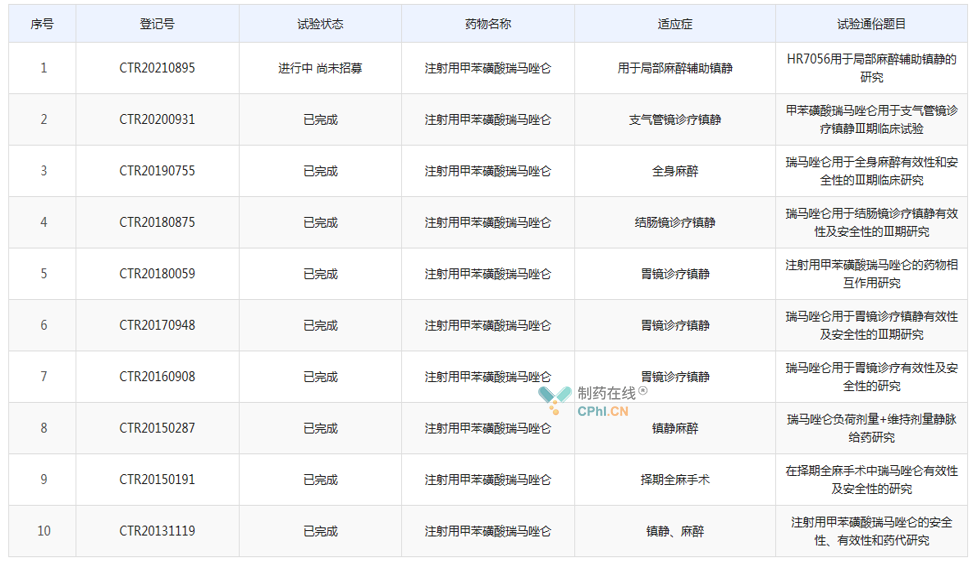
(資料來源:藥物臨床試驗登記與信息公示平臺)
目前�����,恒瑞甲苯磺酸瑞馬唑侖的最大競爭對手是人福的苯磺酸瑞馬唑侖�����,后者于2020年7月獲批上市��。但遺憾的是���,兩者在2020年醫(yī)保談判中均失敗����,目前這兩款產(chǎn)品的掛網(wǎng)價分別為恒瑞266元/36mg/瓶��,人福醫(yī)藥159.9元/25mg/5支����。
一連申報5個適應癥,瑞馬唑侖能否扛起恒瑞**板塊的大旗呢����?**用藥是恒瑞醫(yī)藥的重要特色板塊,使用與醫(yī)療機構的手術數(shù)量關系非常大�����。根據(jù)恒瑞醫(yī)藥2020年年報����,2020年�,營收277.35億元����,同比增長19.09%;歸母凈利潤63.28億元���,同比增長18.78%���。其中,**用藥板塊成為唯一一個營收下降的業(yè)務��,收入為45.91億�����,同比下降16.63%���。疫情逐漸恢復后���,瑞馬唑侖和艾司氯 胺 酮這兩個**新品種銷售能否給力�,還需要時間來檢驗�����。
此外�����,據(jù)中泰證券預測����,甲苯磺酸瑞馬唑侖市場潛力超過10億元����,和丙泊酚中/長鏈脂肪乳協(xié)同性強。




![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57